Laboratorio de Inmunohematología
- Dra. Alejandra Chasseing – Investigadora Principal (CONICET)
El laboratorio de Inmunohematología es dirigido por la Dra. Alejandra Chasseing, y se dedica a uno de los problemas más importantes en la lucha contra el cáncer de mama: entender cómo funcionan y cambian los componentes del entorno en el que se desarrolla esta enfermedad. Es decir, analizar el tumor primario de mama, así como los nichos pre-metastásicos, en particular el de médula ósea/ hueso, suelos fértiles para la futura dormancia de las células tumorales circulantes y la colonización tumoral.
Para esto, trabajan también sobre las poblaciones de bacterias en el tejido mamario, donde poco se sabe sobre los tipos de bacterias y sobre como su actividad metabólica, así como su capacidad de degradar los carcinógenos, pueden contribuir a la evolución tumoral. En base a esto, evalúan el microbioma del tejido tumoral en pacientes con cáncer de mama temprano en Argentina.
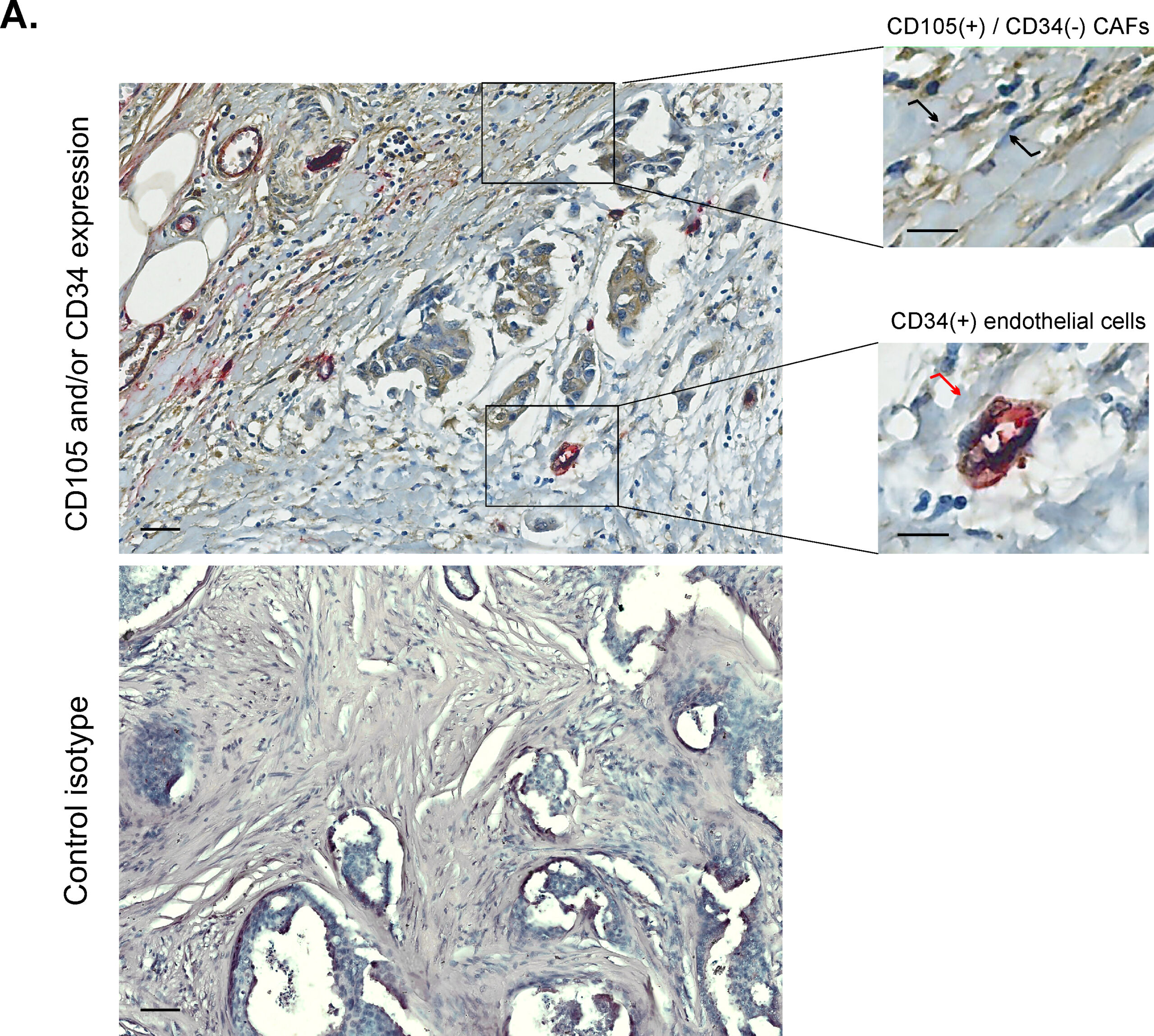
En particular, encontraron que la alta expresión de endoglina (CD105) en fibroblastos asociados al cáncer (CAFs) negativos para el antígeno CD34 es un marcador pronóstico para la ocurrencia de metástasis ósea, y está asociado a un menor tiempo hasta la metástasis, metástasis ósea y menor sobrevida en pacientes con cáncer de mama ductal infiltrante temprana. Por lo tanto, la evaluación de CAFs positivos para CD105 podría ser crucial para clasificar a las pacientes según su perfil de riesgo individual para el desarrollo de metástasis óseas, mejorando así las estrategias y resultados del tratamiento. En el laboratorio, aislaron y cultivaron una clase específica de células mesenquimales estromales o CAFs positivos para CD105 y negativos para CD34 del microambiente del cáncer de mama ductal infiltrante temprano. A través de experimentos biológicos y estudios genéticos, encontraron que estas células pueden influir en el desarrollo del tumor mamario mediante la expresión génica específica, así como la capacidad de proliferación y migración de líneas celulares de cáncer de mama humano.
Por otro lado, encontraron que el tumor de mama primario modifica, a distancia, el microambiente de médula ósea de pacientes con cáncer de mama ductal infiltrante en estadio avanzado III-B, en particular las células madre mesenquimales/ estromales, las cuales adquieren un perfil envejecido/ senescente pro-tumoral, creando así un suelo fértil para la colonización de las células tumorales en médula ósea/ hueso, es decir estas células madre favorecen el desarrollo futuro de metástasis óseas y en otros sitios.
Respecto a los microorganismos, encontraron que cada muestra presenta un perfil bacteriano y metabólico distinto. Los hallazgos sugieren que el oncobioma está en un desbalance microbiano en los tumores primarios de las pacientes con cáncer de mama ductal infiltrante temprano. Además, encontraron que algunas características clínico-patológicas, relacionadas con el estilo de vida y la progresión de la enfermedad, están correlacionadas con ciertos filos y géneros bacterianos, así como con las hipotéticas vías metabólicas involucradas en el microambiente del tumor.
“La expresión de CD105 en CAFs proporciona un parámetro prometedor que no solo es fácilmente detectable, sino también reproducible y eficiente en términos de tiempo en varios subtipos de cáncer de mama, por lo que es un nuevo biomarcador candidato que puede ser fácilmente incorporado en los diagnósticos rutinarios de los servicios de patología de los hospitales”, explicó la Dra. Chasseing, y agrega que “su inclusión mejoraría la precisión de la estratificación del riesgo de metástasis óseas para las pacientes con cáncer de mama, permitiendo decisiones de tratamiento más adecuadas y mejores resultados, por lo que se justifican investigaciones adicionales y estudios de validación para establecer la utilidad clínica y los beneficios a largo plazo de la expresión de CD105 en los CAFs como una herramienta diagnóstica en el manejo temprano del cáncer de mama”.
Sabiendo que la progresión del cáncer de mama hacia una lesión metastásica ósea depende en gran parte de las características del nicho pre-metastásico (“suelo fértil”), y que el establecimiento de este microambiente depende a su vez de las características de las células madre mesenquimales de médula ósea, es de vital importancia para el tratamiento de esta patología el diseño de terapias que incluyan la normalización de las células madre mesenquimales senescentes de las pacientes con cáncer de mama avanzado, ya que revertir este perfil anormal puede ser un enfoque prometedor para el tratamiento y el posible retraso en la aparición de las metástasis en médula ósea/ hueso y por ende mejorar su calidad de vida.
Del estudio del perfil bacteriano y su asociación con datos clínico-patológicos, podrían surgir nuevos biomarcadores dentro del perfil bacteriano del tejido tumoral mamario de buen y mal pronóstico asociados con el tiempo libre de recidiva local, metástasis y sobrevida de la paciente, dando la posibilidad de desarrollar nuevas terapias alternativas como por ejemplo con “probióticos” (utilizando el microbioma de buen pronóstico) que mejoren la calidad de vida de las pacientes.
- La figura muestra la expresión de CD105 y CD34 en células estromales fusiformes, no asociadas a la vasculatura, del tumor primario de pacientes con cáncer de mama (PCM) ductal infiltrante, temprano. Las PCM con mayor cantidad de células positivas para CD105 tienen mayor ocurrencia de metástasis óseas, y por ende menor sobrevida. Panel superior: Doble inmunohistoquímica para CD105 y CD34 (detectados por cromógeno marrón y rojo, respectivamente) muestra un ejemplo representativo de tinción conjunta de CD105 y CD34 en células endoteliales (•) y tinción exclusivamente positiva para CD105 en células estromales fusiformes evaluadas (•) del tumor primario de una PCM. Panel inferior: Controles negativos de isotipo. Los núcleos se tiñeron con hematoxilina (púrpura). Aumento original: ×200. Barras de escala (–). Las células estromales fusiformes, no asociadas a la vasculatura, son símil fibroblastos. CAFs: fibroblastos asociados al cáncer. Front Cell Dev Biol 11: 1250, 2023