Química de Proteoglicanos y Matriz Extracelular
Líneas de Investigación: Reproducción
- Reproducción humana y murina:
Nuestro laboratorio se ha centrado en el estudio de la biología reproductiva masculina y abarca dos líneas de investigación que incluye como objeto de estudio el modelo humano y murino.
Por un lado, nos enfocamos en estudiar cómo ciertos tóxicos, en particular el consumo de alcohol, alteran la reproducción masculina. Es sabido que el consumo de alcohol es considerado una práctica socialmente aceptada, y se le reconoce como vehículo de socialización en diversos grupos sociales, aunque, según la Organización Mundial de la Salud (2015), su uso nocivo es un factor causal en más de 200 enfermedades. Su efecto depende de la cantidad de alcohol consumida, tiempo de exposición y vía de administración. Para llevar a cabo este proyecto desarrollamos un modelo de intoxicación subcrónico y moderado de alcohol por periodos cortos en ratones a partir del cual evaluamos diferentes parámetros reproductivos. Nuestros resultados indican que dicho consumo genera un efecto negativo sobre la integridad y funcionalidad de los espermatozoides. En particular, observamos que el efecto del consumo paterno afecta la funcionalidad espermática reduciendo la hiperactivación de la motilidad y la reacción acrosomal, y aumentando la cinética de descondensación de la cromatina (el ADN espermático se encuentra muy condensado por la asociación a unas proteínas llamadas protaminas, a diferencia de lo que ocurre en otras células, cuyo ADN se enrolla alrededor de otras proteínas llamadas histonas: H2A, H2B, H3 y H4), eventos necesarios para que ocurra la fecundación. También observamos un aumento de la cinética de fecundación in vitro. Además, el consumo de alcohol aumentó la presencia de especies reactivas de oxígeno y disminuyó la presencia de la histona H3K4me3 (esta forma de denominación indica lo siguiente: “en la histona 3, el aminoácido lisina 4 se encuentra trimetilado”. Este tipo de modificación química es parte de lo que se conoce como epigenética que comprende los cambios que, sin modificar la secuencia de bases en el ADN, sin embargo, modifican la manera en que se expresan los genes) en los espermatozoides de los ratones alcoholizados pudiendo tener consecuencias a nivel epigenético. En las gónadas dicho consumo alteró la estructura testicular y aumentó la fragmentación del ADN en la línea germinal. Además, observamos que el consumo de alcohol paterno provocó una desregulación de los eventos de peri-implantación y la alteración de la morfogénesis embrionaria ya que retrasó la diferenciación embrionaria en el desarrollo in vitro de embriones desde dos células hasta el estadio de blastocisto expandido afectando el macizo celular interno (células que darán origen a todo el organismo) y el trofoblasto (células que darán origen a la placenta) pudiendo afectar el desarrollo placentario y por ende, la supervivencia de los embriones. Por otro lado, se han observado efectos en la descendencia de estos padres consumidores detectando cambios en el comportamiento, el perfil inmunológico y la biología reproductiva de la progenie masculina. En este último punto observamos, a nivel testicular, diferencias en el peso, la estructura y la producción diaria de espermatozoides y a nivel epigenético observamos un aumento de la presencia de ciertas marcas epigenéticas de histonas espermáticas (H3K9me y H4K12ac) (en este caso, ac indica acetilación). Nuestros resultados indican que el consumo de alcohol paterno, a corto plazo, altera la calidad de los espermatozoides epididimarios y la integridad testicular, tanto en los consumidores como en su descendencia, pudiendo alterar la biología reproductiva masculina en ambas generaciones. Esto pone de manifiesto que el consumo paterno de alcohol a corto plazo, en un modelo murino, genera alteraciones, no solo a nivel sistémico y de los parámetros reproductivos, sino que puede repercutir sobre la salud orgánica y comportamental de la descendencia.
En una segunda línea de investigación, hemos analizado en profundidad el proceso de descondensación de la cromatina espermática proponiendo al Heparán sulfato como posible agente descondensante in vivo dado que lo hemos encontrado en ovocitos humanos y de ratón. También hemos observado ausencia de descondensación de la cromatina espermática cuando los espermatozoides son incubados en presencia de heparinasa, reforzando el rol del heparán sulfato en este proceso fisiológico. También hemos encontrado que el estudio de la descondensación de espermatozoides in vitro puede estar relacionado con el éxito de la reproducción asistida al poder distinguir dos poblaciones de pacientes mediante la evaluación de la cinética de descondensación de espermatozoides humanos in vitro: descondensadores rápidos y descondensadores lentos. Encontramos que aquellos pacientes descondensadores rápidos poseen mejor calidad embrionaria, lo que sugiere que la descondensación anormal puede tener un efecto negativo en el embrión que podría evidenciarse más adelante durante el desarrollo. A su vez, considerando dos indicadores de integridad del DNA, como la descondensación y la fragmentación del DNA, observamos que los pacientes descondensadores lentos con alta fragmentación del DNA espermático no lograron embarazos clínicos y, en consecuencia, no se observaron nacimientos vivos. Actualmente estamos avanzando en el estudio del rol epigenético en espermatozoides humanos y sus posibles consecuencias a nivel clínico.
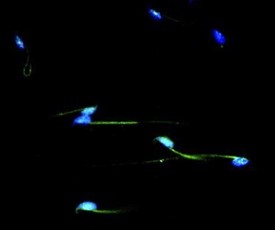
Imágenes representativas de la localización de las marcas positivas (verde) de la histona H3K4me3 (candidata a los posibles efectos nocivos en la descendencia masculina) en los espermatozoides de ratón. Los núcleos de los espermatozoides fueron teñidos con DAPI (azul).