Investigadores del IBYME colaboraron con Investigadores de Weill Cornel Medicine en un trabajo publicado en la revista Nature en el cual describen claves moleculares por las cuales el cáncer de ovario inhibe la respuesta inmunológica.
En la actualidad uno de los mayores enigmas consiste en comprender por qué algunos tumores, en este caso el cáncer de ovario, generan mecanismos de escape inmunológico. El trabajo liderado por el Dr. Juan Cubillo Ruiz de Weill Cornel Medicine en el cual colaboraron los Dres. Gabriel Rabinovich, investigador superior del CONICET y Juan Pablo Cerliani, investigador adjunto, ambos del Instituto de Biología y Medicina Experimental (IBYME, CONICET-FIBYME), fue publicado hoy en la revista Nature, junto con colaboradores de otras instituciones mundiales.
Es un trabajo que responde a una pregunta crucial en la biología de los tumores, plantean los investigadores: ¿por qué algunos tumores evaden la respuesta inmunológica? “La inmunoterapia empezó a funcionar en muchos pacientes, entre ellos pacientes con melanoma, cáncer de pulmón, linfoma Hodgkin; pero hay tumores cuyos mecanismos de evasión son diferentes”, explica Rabinovich.
Los investigadores, liderados por Cubillo Ruiz, encontraron que la inhibición de dos proteínas llamadas IRE-1a y XBP-1, en ratones, sería efectiva para aumentar el ataque inmunológico (de linfocitos T) en cáncer de ovario.
El ambiente hostil inflamatorio que genera el cáncer de ovario (llamado ascitis) contiene factores solubles que bloquean un transportador de glucosa, llamado GLUT-1 en los linfocitos T, que son los glóbulos blancos que deberían atacar al tumor, dejándolos inactivos o ‘paralizados’.
La investigación que presentaron vincula cuatro procesos celulares: el ingreso de glucosa a la célula y su utilización, el estrés del retículo endoplasmático, la glicosilación de proteínas, y la respiración mitocondrial.
“Al no poder ingresar la glucosa al interior del linfocito T, las proteínas no se glicosilan y eso activa la maquinaria involucrada en el llamado “estrés de retículo endoplasmático” –en la organela donde se sintetizan las proteínas. En este proceso son protagonistas las proteínas IRE1a y XBP-1. Este estrés celular genera una disrupción celular en el linfocito T que dificulta a su vez, el transporte de la glutamina y su posterior ingreso a la mitocondria (segunda fuente de energía) impidiendo la respiración celular, fenómenos claves para que esta organela cumpla su función y genere energía. Esta cascada de disfunciones celulares promueve la parálisis de linfocito T y su incapacidad de producir interferón-gama, una citoquina clave para eliminar dichos tumores”, explica Rabinovich.
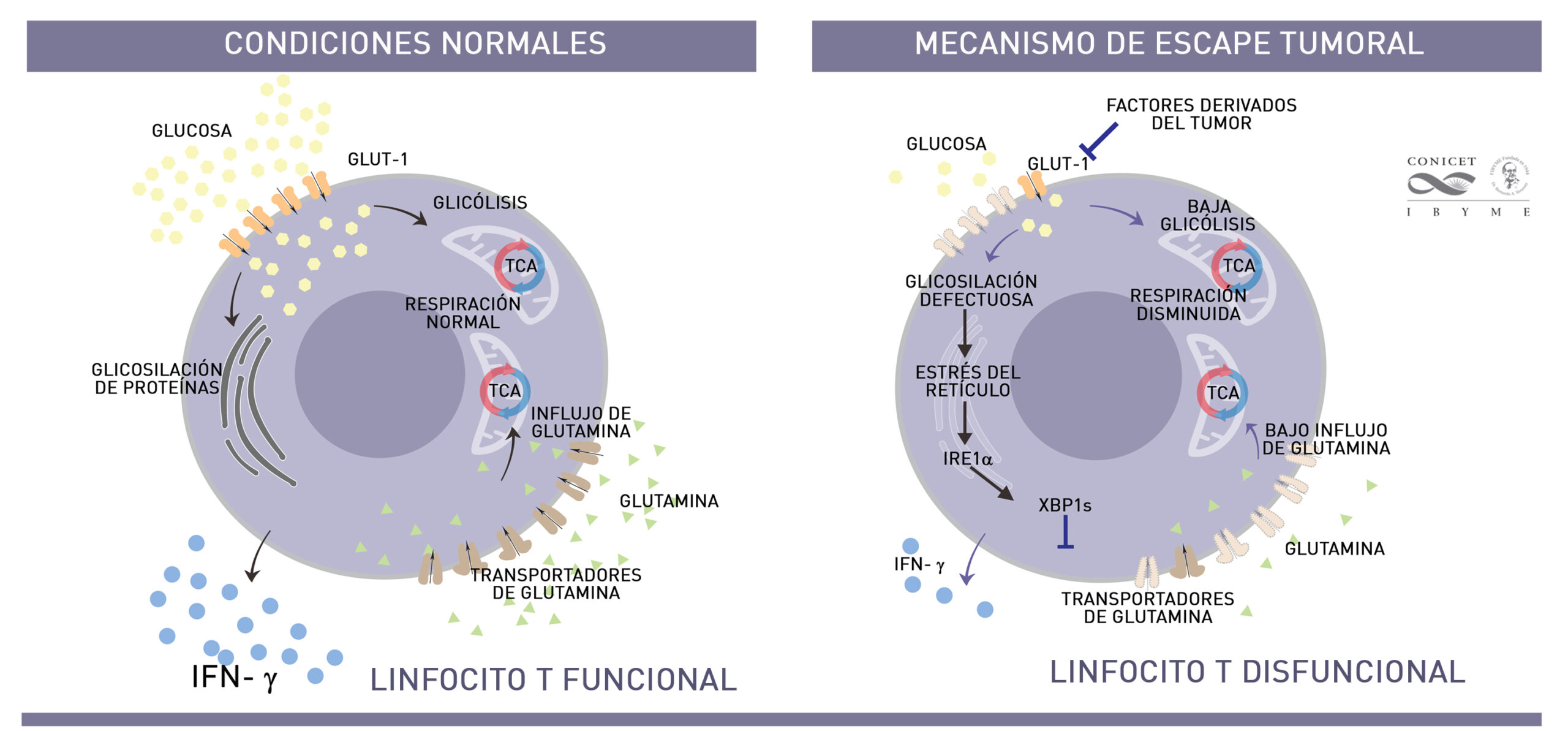
Realización: IBYME – Adaptación de IRE1α–XBP1 controls T cell function in ovarian cancer by regulating mitochondrial activity
“Juan Cubillo Ruiz viene trabajando desde hace muchos años en la importancia de la respuesta inmunológica en cáncer de ovario y hace unos años, en un Congreso científico en USA, nos propuso participar en un área fundamental del trabajo para desentrañar aspectos glicobiológicos de la comprensión de esta historia, y así resolver el enigma de los mecanismos que operan en el crecimiento de cáncer de ovario”, cuenta Rabinovich.
“En un primer momento, quisimos ver si la galectina 1, una proteína que trabajamos en nuestro laboratorio, podría estar involucrada, pero los resultados no sustentaron esta posible hipótesis”.
Colaboración internacional.
El trabajo involucró la colaboración de diversas instituciones. Weill Cornel (con Juan Cubillo Ruiz liderándolo), Dana Farber Cancer Institute (con Laurie Glimcher), Moffit Cancer Institute (con José Conejo García) y el IBYME. Desde el IBYME los investigadores participaron fundamentalmente en aspectos glicobiológicos que permiten vincular los fenómenos celulares observados.
En relación a aspectos experimentales, varios de los ensayos que se realizaron en el laboratorio de Inmunopatología estuvieron relacionados con la glicosilación de diferentes proteínas de células de nuestro sistema inmunológico, linfocitos T, que son las encargadas de reconocer y eliminar células tumorales.
“Aprendimos muchísimo sobre temas de los que desconocíamos, como estrés de retículo, respiración mitocondrial”, cuenta Cerliani, y agrega: “Todo se fortalece y se nutre en este tipo de colaboraciones fuertes”.
“Fue un gran honor contribuir para construir este trabajo y que el Dr. Cubillo Ruiz nos invite a participar, desde una perspectiva interdisciplinaria en la interfase de la inmunología, la glicobiología, el metabolismo celular y la biología tumoral”, concluye Rabinovich.
Sobre investigación:
IRE1α–XBP1 controls T cell function in ovarian cancer by regulating mitochondrial activity
Minkyung Song. Weill Cornell Medicine, Nueva York, Estados Unidos.
Tito A. Sandoval. Weill Cornell Medicine, Nueva York, Estados Unidos.
Chang-Suk Chae. Weill Cornell Medicine, Nueva York, Estados Unidos.
Sahil Chopra. Weill Cornell Medicine, Nueva York, Estados Unidos.
Chen Tan. Weill Cornell Medicine, Nueva York, Estados Unidos.
Melanie R. Rutkowski. University of Virginia. Charlottesville, Estado Unidos.
Mahesh Raundhal. Dana-Farber Cancer Institute y Harvard Medical School and Brigham and Women’s Hospital, Boston, Estados Unidos.
Ricardo A. Chaurio. H. Lee Moffitt Cancer Center & Research Institute. Tampa, Estados Unidos.
Kyle K. Payne. H. Lee Moffitt Cancer Center & Research Institute. Tampa, Estados Unidos.
Csaba Konrad. Weill Cornell Medicine, Nueva York, Estados Unidos.
Sarah E. Bettigole. Quentis Therapeutics, Inc., New York, Estados Unidos.
Hee Rae Shin. Quentis Therapeutics, Inc., New York, Estados Unidos.
Michael J. P. Crowley. Weill Cornell Medicine, Nueva York, Estados Unidos.
Juan P. Cerliani. Investigador adjunto CONICET, IBYME.
Andrew V. Kossenkov. The Wistar Institute, Philadelphia, Estados Unidos.
Ievgen Motorykin. Cornell University, Ithaca, Nueva York, Estados Unidos.
Sheng Zhang. Cornell University, Ithaca, Nueva York, Estados Unidos.
Giovanni Manfredi. Weill Cornell Medicine, Nueva York, Estados Unidos.
Dmitriy Zamarin. Memorial Sloan Kettering Cancer Center, New York, Estados Unidos.
Kevin Holcomb. Weill Cornell Medicine, Nueva York, Estados Unidos.
Paulo C. Rodriguez. H. Lee Moffitt Cancer Center & Research Institute. Tampa, Estados Unidos.
Gabriel A. Rabinovich. Investigador superior CONICET, IBYME y Facultad de Ciencias Exactas y Naturales, UBA.
Jose R. Conejo-Garcia. H. Lee Moffitt Cancer Center & Research Institute. Tampa, Estados Unidos.
Laurie H. Glimcher. Dana-Farber Cancer Institute y Harvard Medical School and Brigham and Women’s Hospital, Boston, Estados Unidos.
Juan R. Cubillos-Ruiz. Weill Cornell Medicine, New York.




