El trabajo publicado en PNAS ofrece nueva y sustanciosa información sobre el proceso de maduración de los espermatozoides.
La proteína quinasa A (PKA) es una enzima reguladora de diversos procesos celulares, uno de los cuales es la capacitación, el proceso de maduración que los espermatozoides deben pasar luego de la eyaculación, antes de poder ser capaces de fecundar al ovocito.
En condiciones basales, las subunidades catalizadoras de la PKA son bloqueadas por subunidades regulatorias, pero durante la capacitación, PKA es estimulado por AMP cíclico para activar vías de señalización claves para que el espermatozoide adquiera la capacidad fecundante.
Este trabajo utilizó microscopía de superresolución en tres dimensiones para determinar la forma en que estas subunidades interactúan y relocalizan durante la capacitación. Si bien ya existen estudios sobre el comportamiento de las subunidades catalizadoras durante el proceso, y la forma en que se redistribuyen, en este caso se comprobó que las regulatorias también modifican su ubicación: “Lo más interesante además de que la subunidad regulatoria se desplaza, es hacia dónde lo hace. Gracias al uso de técnicas de superresolución, pudimos observar que esta proteína se acerca al canal de calcio Catsper, que ejerce un rol fundamental en la capacitación y la movilidad del espermatozoide”, explica Mariano Buffone, Director del laboratorio de Biología Celular y Molecular de la Reproducción.
Esto convertiria a las PKA regulatorias en un excelente biomarcador, que permitiría identificar el proceso de capacitación en un espermatozoide, como explica Buffone: “Es muy importante cómo funciona este complejo clave para la capacitación, ya que es central para que el espermatozoide fecunde, pero además hipotetizamos que éste puede ser un marcador importante para poder detectar qué espermatozoides se han capacitado correctamente”.
El trabajo “Dynamic relocation of PKA regulatory subunits during sperm capacitation: Linking PKA to the CatSper signaling complex” publicado en PNAS (Proceedings of the National Academy of Sciences of the United States of America) es el resultado del trabajo en colaboración de profesionales de cuatro instituciones liderados por el Dr Mariano Buffone (IBYME, Ciudad Autónoma de Buenos Aires), el Dr Dario Krapf (IBR, Rosario, Santa Fe), el Dr Fernando Stefani (IBIOBA, Ciudad Autónoma de Buenos Aires), y el Dr Diego Krapf (Colorado State University, Colorado, USA).
La publicación profundiza el conocimiento sobre las PKA, pero abre también el camino a proyectos futuros para el grupo: “Queremos dilucidar con que proteínas esta interaccionando la subunidad regulatoria de PKA y cuál sería su role regulatorio de este proceso, y también como se produce este proceso de relocalización en condiciones fisiológicas del espermatozoide, como, por ejemplo, en qué lugar específico del tracto reproductor femenino se activa este proceso”, cierra Buffone.
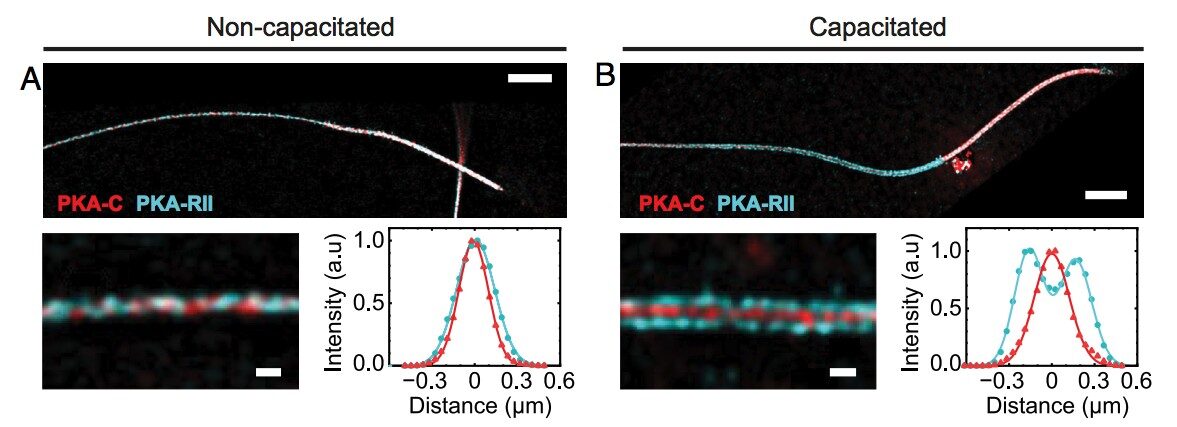
Fig. 1 de publicación de referencia.
- (A) Imagen representativa de Inmunofluorescencia de PKA-C y PKA-RII en una célula no capacitada. La sección transversal de intensidad muestra un perfil tipo gaussiano de un solo pico para ambas señales. (B) PKA-C y PKA-RII en una célula estimulada con medio inductor de la capacitación. La sección transversal de intensidad muestra un solo pico para PKA-C y una distribución de doble pico para PKA-RII.
Sobre publicación:
Dynamic relocation of PKA regulatory subunits during sperm capacitation: Linking PKA to the CatSper signaling complex
Analia G Novero, Arturo Matamoros-Volante, Lucila R Gomez-Olivieri, Cintia Stival, Guillermina M Luque, Alan M Szalai, Andrea L Ambrosio, Fernando D Stefani, Mariano G Buffone, Dario Krapf, Diego Krapf